

| |||||||||
 | |||||||||
2.2 Разработка аппаратно-программного комплекса для установления прямого взаимодействия нервной ткани с искусственными (техническими) системами 2. Необходимость выполнения предлагаемых работ 2.1 Актуальность проекта. Исследования возможности взаимодействия биологических и технических систем начались, вероятно, с опытов Луиджи Гальвани. В этих опытах впервые было показано, что электрический ток способен вызвать сокращение мышц. В дальнейшем было выполнено множество исследований, в которых использовались различные типы электродных систем для регистрации активности биологических объектов и оказания на них электрических воздействий. Подобные системы используются как при экспериментальных работах, так и при создании различного рода устройств для восстановления утраченных функций, при протезировании. Одним из главных недостатков таких интерфейсов заключается в несоизмеримость размеров электрода и того объекта (нейрон, нервный отросток, мышечная клетка) от которого нужно зарегистрировать сигнал или оказать воздействие. Кроме того существующие электродные системы обладают недостаточной долговечностью. Особенно при необходимости их имплантации. Есть несколько причин такой недолговечности. В большинстве случаев в качестве электродов используются проводники с электронной проводимостью. При этом основные явления в биологических системах опосредованы ионными процессами. На границе электронных и ионных проводников происходит комплекс явлений ведущих в конечном итоге к ослаблению работы таких контактов. Попытки избежать этих процессов основаны на использовании на границе ионный-электронный проводник различных электропроводных гелей. Это значительно улучшает характеристики и увеличивает время работы таких устройств. Однако при этом возникают проблемы связанные с накоплением в таком геле клеточных метаболитов, затруднения увеличения пространственной избирательности, невозможности оказать через такой контакт многих физико-химических воздействий и регистрации биофизических характеристик клеток, находящихся в контакте с электродами. В связи с острой необходимостью создания биотехнических интерфейсов, контактных устройств с высоким пространственным разрешением, достаточно долго действующих и с появившимися возможностями создание нового типа контактов на основе нанотрубок такие разработки представляются чрезвычайно актуальными. 2.2.Современное состояние исследований в данной области науки, сравнение ожидаемых результатов с мировым уровнем. Существующие методы работы с клетками in vitro ориентированы либо на биохимические исследования популяции или клеточного клона, либо на индивидуальный анализ характеристик и реакций отдельных клеток (в нейрональных культурах). Проводятся разработки устройств, позволяющих проводить регистрацию биофизических характеристик изолированных нейронов и оказания на них управляемых воздействий. Так компания Infineon Technologies разработала микросхему, способную, потенциально, взаимодействовать сразу более чем с 16 тысячами нейронов (1) (Рис. 1). Однако в этих разработках воздействия ограничиваются в основном электрическими стимулами. Разработка методологии для регистрации характеристик одновременно от большого числа клеток позволила создать комплексы для первичного отбора и характеризации фармакологически перспективных соединений (2). Эти комплексы ориентированы на потребности фармакологических отраслей и позволяют ускорить испытание новых лекарственных средств, уменьшить требования к квалификации персонала и, как следствие, существенно сократить расходы на создание нового препарата. Однако подобные системы не позволяют осуществлять непосредственный информационный обмен между биологическими и техническими системами. Они не способны обеспечить достаточно полный биофизический анализ состояния биологических систем, создание биологической обратной связи корректирующей это состояние, оказание внутриклеточных воздействий, инъекций препаратов и высокомолекулярных соединений, что существенно сокращает сферу их применения. Одним из важнейших параметров особенно у электровозбудимых клеток являются характеристики состояния их ионных каналов. Основными подходами к исследованиям ионных каналов являются различные электрофизиологические методы, в частности, метод регистрации токов ионных каналов при фиксации потенциала на участке мембраны клетки (петч-кламп). Технологии пэтч-клампа позволяют контролировать мембранный потенциал и измерять потенциал зависимые ионные токи, т.е. определять основные характеристики клеток, с которыми формируется взаимодействие. Однако такая технология анализа сталкивается с многочисленными трудностями, включая необходимость в высококвалифицированных исследователях, небольшую скорость получения достоверного результата на изолированных клетках, особенно с учетом вариабельности в уровне экспрессии от клетки к клетке. Эти факторы в совокупности с низкой производительностью традиционного пэтч-клампа одиночных клеток значительно понижают эффективность этого метода. Поэтому исследование ионных каналов являются чрезвычайно важным, но недостаточно доступным методом анализа биологических объектов необходимым, в том числе, и при разработке устройств биотехнического взаимодействия. К решению этой проблемы приближают разработки многоканального (популяционного) пэтч-кламп метода проводимые рядом компаний (Molecular Devices Inc. [3-9], Nanion Technologies [10], Рис. 2,). Однако и в этих разработках присутствует ряд ограничений. Такие ограничения обусловлены неоднородностью контактов клеток с порами, значительным размером пор не позволяющим проводить регистрацию токов одиночных ионных каналов. Возникает необходимость использования фармакологических препаратов (антибиотиков, могущих вносить дополнительную неоднозначность в результаты) для разрушения мембраны клетки в районе поры. Отсутствует возможность контролировать работу ионного канала при действии не проникающего через мембрану клетки вещества. При создании биотехнических интерфейсов чрезвычайно важен анализ функционирования сопряженных с ионными каналами (как основными выходными, эффекторными устройствами клеток) внутриклеточных молекулярных ансамблей. На решение этих и ряда других проблем и направлен данный проект. Планируемая разработка расширит область применения планшетных устройств и позволит объединить технические возможности проведения информационных биотехнических взаимодействий и фармакологических и/или генетических модификаций массивов клеток, контролируя при этом их биофизические параметры.
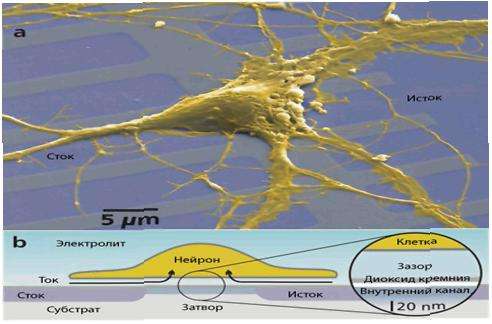
Рис.1. Нейрон на подложке из полевых транзисторов Infineon Technologies [1, 2].
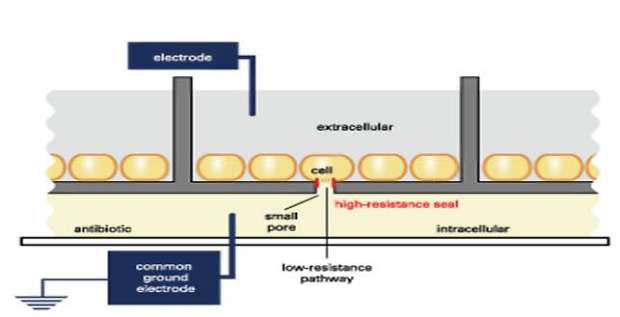
Рис. 2. Схема многоканальной пэтч-кламп клетки, иллюстрирующая принцип технологии IonWorks HT system (Molecular Devices) и SyncroPatch 96 (Nanion Technologies) – позволяет осуществлять пэтч-кламп измерения ионных токов с 96 клеток одновременно. Перспективным является возможность использования микро и наноустройств для контроля клеточной активности: полевые транзисторы на нанотрубках и нанопроволоках (как внеклеточные и внутриклеточные сенсоры), измерение электромагнитного поля в клетках, регистрация эванесцентных волн, емкостные методы, терагерцовая спектроскопия, СВЧ методы [11-20]. Список литературы: 1. http://www.biochem.mpg.de/en/eg/fromherz/ 2. http://www.infineon.com/cms/en/product/index.html 3. H Guthrie, FS Livingston, U Gubler, R Garippa A place for high-throughput electrophysiology in cardiac safety: screening hERG cell lines and novel compounds with the IonWorks HT system. J Biomol Screen, 10(8): p. 832-40. (2006). 4. L Kiss, PB Bennett, VN Uebele, KS Koblan, SA Kane, B Neagle, K Schroede High Throughput Ion-Channel Pharmacology: Planar-Array-Based Voltage Clamp. Assay and Drug Dev. Technologies 1(1-2):127-135. (2003) 5. IonWorks HT: A New High-Throughput Electrophysiology Measurement Platform. J Biomol Screen, 8(1):54-60 (2003) 6. Novel 384-Well Population Patch Clamp Electrophysiology Assays for Ca2+ Activated K+ channels, J of Biomol Screen 12(1):50-60 (2007) 7. Tim J. Dale, Claire Townsend, Emma C. Hollands and Derek J. Trezise Population patch clamp electrophysiology: a breakthrough technology for ion channel screening. Molecular Biosystems (2007) 8. Validation of high throughput screening assays against three subtypes of Ca(v)3 T-type channels using molecular and pharmacologic approaches. Assay Drug Dev Technol, 5(2): p. 191-203 (2007) 9. http://www.moleculardevices.com/pages/instruments/electrophys_main.html 10. http://www.nanion.de 11. T. Cohen-Karni , B.P. Timko , L.E. Weiss , C.M. Lieber, Flexible electrical recording from cells using nanowire transistor arrays, Proc Natl Acad Sci U S A, 2009, 106(18), 7309-13. 12. Heller, W. T. T. Smaal, S. G. Lemay, and C. Dekker Probing Macrophage Activity with Carbon-Nanotube sensor, Small 2009, 5, No. 22, 2528–2532/ 13. Y. Hu, D.H. Fine, E. Tasciotti, A. Bouamrani, M Ferrari. Nanodevices in diagnostics, Wiley Interdiscip Rev Nanomed Nanobiotechnol. 2011, 3(1), 11-32. 14. H. Helmers, P. Greco, R. Rustad, R. Kherrat, G. Bouvier, and P. Benech, Performance of a compact, hybrid optical evanescent-wave sensor for chemical and biological applications, Appl. Opt. 1996, 35(4), 676-680. 15. C.-C. Lin, M.-T. Kuo, H.-C. Chang, Review: Raman Spectroscopy – A Novel Tool for Noninvasive 16. Analysis of Ocular Surface Fluid, Journal of Medical and Biological Engineering, 2010, 30(6), 343-354. 17. J. F. Eschermann, R. Stockmann, M. Hueske, X. T. Vu, S. Ingebrandt, and A. Offenh?usser, Action potentials of HL-1 cells recorded with silicon nanowire transistors, Appl. Phys. Lett. 2009, 95, 083703. 18. B. Tian, T. Cohen-Karni, Q. Qing, X. Duan, P. Xie, C. M. Lieber, Three-Dimensional, Flexible Nanoscale Field-Effect Transistors as Localized Bioprobes, Science, 2010, 830, 329. 19. Q. Qinga, S.K. Pal, B. Tiana, X. Duana, B. P. Timkoa, T. Cohen-Karni, V. N. Murthy, and C.M. Lieber, Nanowire transistor arrays for mapping neural circuits in acute brain slices, PNAS 2010, 107(5) , 1882-1887. 20. Y.Mei, K. Saha, S. R. Bogatyrev, J. Yang, A. L. Hook, at al, Combinatorial development of biomaterials for clonal growth of human pluripotent stem cells, Nature Materials 2010, 9, 768–778 2.3. Конкурентный анализ: Оценка собственных сильных и слабых сторон относительно конкурентов В отличие от большинства существующих матричных устройств, в которых в качестве контактных площадок используются различные металлические поверхности (проводники электронов) в разрабатываемом комплексе предполагается создавать ион-ионные контакты с клетками. При этом переход ионный проводник - электронный проводник будет удален от биообъекта. В отличие от гелиевых контактов трубчатые ионные электроды позволяют свободный транспорт клеточных метаболитов из зоны контакта и возможность регистрации биофизических характеристик клеток в зоне контакта. Все это в целом позволяет выполнить биотехнические соединения со стабильными в течение длительного времени свойствами. Технико-экономические преимущества. Созданный коллективом подход и набор технологий позволяет разрабатывать, создавать и исследовать системы типа “brain-computer interface” – прямого взаимодействия биологических и технических устройств для быстродействующего управления техническими системами. Кроме того, разработанный аппаратно-программный комплекс и многоканальная матрица со стабильными параметрами при длительной эксплуатации в тканях позволит проводить разработку биотехнических систем, используемых в диагностических, лечебных, компенсаторных целях (биопротезирование) в биологии и медицине. В исследованиях и разработках, направленных на тестирование соединений и воздействий, определение их потенциальной опасности. Все перечисленное дает возможность существенно упростить и в разы удешевить такие разработки и исследования. Области применения. Для выполнения перечисленных задач создан макетный вариант аппаратно-программного комплекса. Этот комплекс используется в области биологической и медицинской информатики, для первичного тестирования фармакологически перспективных соединений и физико-химических воздействий, при разработках биосенсорных комплексов и биотехнических интерфейсов (в том числе на основе нанотехнологий). Разработанный комплекс, используется в работах по грантам ИНТАС, РФФИ, программах РАН и СО РАН. Работы проводились совместно с Университетами Генуи и Копенгагена, Институтом физиологии РАН, Институтом химического синтеза РАН, Институтом цитологии и генетики СО РАН, Институтом лазерной физики СО РАН, Новосибирским институтом органической химии СО РАН, Институтом систематики и экологии животных СО РАН, Тихоокеанским институтом органической химии ДВО РАН, Институтом молекулярной биологии и биофизики СО РАМН и Центральным сибирским ботаническим садом. Данная разработка и послужила прототипом настоящего проекта. Используя возможности полупроводниковой технологии, планируется перейти к матричным устройствам для создания интерфейса с нейронными системами. Опыт совместной работы позволяет перейти от последовательной работы с единичными клетками к одновременной, параллельной регистрации параметров массивов клеток, проведения фармакологических и генетических модификаций клеточных популяций, контролируя при этом их биофизические, биохимические и морфологические характеристики. 2.4. Имеющийся у коллектива научный задел по предлагаемому проекту: полученные ранее результаты (с оценкой степени оригинальности), разработанные методы (с оценкой степени новизны) Для реализации проекта имеются следующие заделы в Конструкторско-технологическом Институте вычислительной техники СО РАН и Институте физики полупроводников СО РАН: Конструкторско-технологический Институт вычислительной техники СО РАН (КТИ ВТ СО РАН) в течение длительного периода занимается теоретико-экспериментальным анализом функциональных свойств и молекулярных механизмов работы нейронных систем. Работа ориентирована на выявление основных информационных свойств нервных клеток и простых нейронных ассоциаций как молекулярных информационных систем, структурно-функциональной организации и механизмов работы таких систем. На нейронах, культивируемых вне организма, с применением традиционных методик и матричных устройств ввода-вывода информации создаются биотехнические комплексы. Решаются задачи возможности выработки аналогов реакций привыкания (уменьшения ответов на неассоциированный сигнал), инструментального условного рефлекса (увеличения ответов на ассоциированный сигнал), избегания стимула (минимизации действия), запоминания входных сигналов и их опознания при последующем предъявлении, управления с внешней биологической обратной связью. Определяются молекулярные ансамбли, вовлеченные в информационные процессы, и выявляется роль организации взаимодействия различных молекулярных систем клетки как молекулярной информационной системы. Исследуется роль транспортных белков (миозинов) и актинового цитоскелета на ключевых, участках нейронов (формируемых в процессе обучения, запоминания и последующего анализа картины внешнего мира) структурно-функциональных микродоменах на различных этапах работы таких систем. Развита концепция для анализа и отбора биологически активных соединений по биофизическим характеристикам клеток, имеется все необходимое оборудование для работы с культурами клеток и тканей, имеется измерительное оборудование для электрофизиологических и имиджинговых исследований, опыт компьютерного моделирования механизмов действий биологически активных соединений и др. физико-химических воздействий. Опыт работы с клетками, клеточными системами, биологической обратной связью, биологически активными соединениями и воздействиями, в биофизике и электрофизиологии – более 30 лет. Работа в части матричных устройств проводится на базе более ранних разработок лаборатории (Shtark, Ratushniak, Voskresenskaia, 1974). Впервые показана возможность управления внешними техническими устройствами с помощью обучаемых избеганию воздействий нервных клеток (Ratushniak A.S, Voskresenskaia L.V, Pankova T.M, 1976). Комплексная работа, позволившая выявить основные информационные возможности нервных клеток (распознания многомерного вектора внешнего сигнала, его классификации, реакции на основе ассоциаций с образами из ранее записанных или генетически детерминированных и управления эффекторами) и анализ возможных молекулярных механизмов реализации таких реакций выполнена впервые (Ratushnyak A.S., Zapara T.A., 2009). Идеология биотехнического комплекса, который является целью настоящего проекта, в значительной степени уже разработана и апробирована в лаборатории биомедицинской информатики КТИ ВТ СО РАН. Разработан и создан пилотный образец биосенсорного комплекса, в котором регистрируется электрические и имиджинговые сигналы единичных нейронов и простых нейронных структур. Работа комплекса основана на определении биофизических параметров живых клеток и простых клеточных систем, используемых в качестве биосенсоров. Набор регистрируемых параметров клеток включает: потенциал покоя, мембранный потенциал, набор динамических характеристик потенциала действия, кинетические параметры работы, потенциал и лиганд чувствительных трансмембранных ионных каналов (натриевых, калиевых, кальциевых, хлорных) и др. Доступность для регистрации имиджинговых характеристик позволяет расширить набор регистрируемых характеристик с использованием широкого спектра существующих красителей. Анализ взаимосвязи перечисленных параметров позволяет: 1. определить биологическую активность фармакологически перспективных соединений и других физико-химических воздействий, зависимость эффекта от дозы, направленность, скорость развития и характеристики обратимости эффекта; 2. определить минимальную и предельную (токсическую) концентрацию; 3. выявить внутриклеточные мишени и молекулярно-клеточные механизмы; 4. обнаружить эффекты действия наноформ веществ, излучений (например, терагерцового) и других факторов малоисследованной природы. Комплекс включает: 1. регистрирующую установку, обеспечивающую поддержку жизнедеятельности объекта, контроль его биофизических параметров и моделирование состояний (патологий); 2. системы управления, сбора и обработки данных; 3. базы знаний и данных; 4. набор оборудования и технологий для подготовки объектов и датчиков; 5. модели внутриклеточных молекулярных процессов.
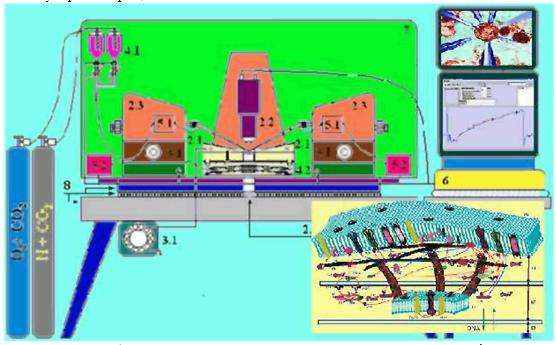 Рис. 3. Рабочая станция комплекса для исследования информационных процессов в нейронах, простых нейронных сетях и тестирования биологически активных веществ и воздействий. В Институте физики полупроводников (ИФП СО РАН) разработана и используется уникальная российская технология формирования полупроводниковых биосовместимых кремниевых микро и нанотрубок и массивов на их основе, опыт в разработке существенно более сложных матриц со считыванием результатов измерений (матрицы ИК- фотоприемников, содержащие 300 тыс. элементов). Имеется многолетний задел по разработкам приборов: ГРАН 1-6, C-V DLTS спектрометры, СВЧ диагностика многослойных систем, установки по измерению времени жизни зарядов, ИК диагностика, элипсометры, большинство приборов применяются в промышленности. ИФП СО РАН имеет все необходимое оборудование для микро и нано конструирования (полупроводниковые технологии). Кроме того, обладает собственной технологией изготовления полупроводниковых микро и нано-трубок, которые могут применяться для внутриклеточных микроинъекций и в качестве электрода для измерения мембранного потенциала. Эти технологии успешно испытаны при работе с отдельными клетками. Опыт работы в области нанотехнологий, в разработке сенсоров и методов регистрации, – более 20 лет, Существенное уменьшение размеров элементов приборов (до 104 раз) по сравнению с аналогами, а также переход к инструментам с атомно-острыми и гладкими краями откроет новые возможности в исследованиях и практических применениях. Выполнение настоящего проекта будет базироваться, в том числе, на разработанной в ИФП СО РАН технологии формирования трехмерных наноструктур - атомно гладких микро- и нанооболочек (трубок, спиралей и т.п.) Диаметры трубок, создаваемых по нашей технологии, контролируемо задаются в диапазоне от 100 мкм до 2 нм, толщина стенки трубки от десятков до 1 нм, причем край-острие пленки будет сформирован с радиусом кривизны до 0.5 нм. Благодаря настолько острым краям игл, микрохирургические вмешательства становятся низко травмирующими. Таким образом, при проколе стенки клетки будут нанесены минимальные повреждения, и не потребуется больших усилий для осуществления прокола. Такие трубки и пленки изготавливаются технологией совместимой со стандартной планарной полупроводниковой технологией, благодаря этому могут изготавливаться массовым образом. Планируемые результаты будут обладать существенной новизной и преимуществом по сравнению с известными в мировой практике. Всей совокупностью технологий необходимых для создания таких инструментов и разработки метода владеем только мы.
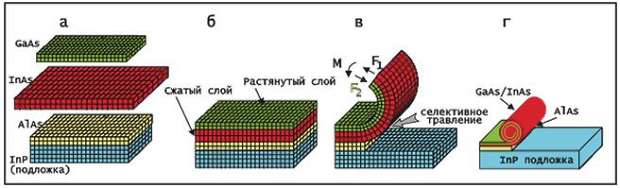 Рис. 4. Схематическая иллюстрация процесса формирования нанотрубок. а - слои InAs и GaAs с разными постоянными решеток в свободном состоянии; решетка InAs на 7.2 % больше решетки GaAs; б - сопряжение слоев с помощью эпитаксиального роста; в - изгиб двухслойной пленки при ее освобождении от связи с подложкой; г - самосворачивание двухслойной пленки в трубку при селективном удалении жертвенного слоя AlAs, дополнительно выращенного между пленкой и подложкой (Prinz, et al., Physica E. 2000 p. 828). Диапазон диаметров реализованных трубок с контролируемым диаметром от 2 нм до 200мкм, длиной до нескольких см. Важно подчеркнуть, что трубки, изготовленные из тонких нанопленок, обладают атомно-острыми краями. Это позволяет, прикладывая слабые усилия вдоль оси трубок, прокалывать не только клетки животных, но даже толстые оболочки растительных клеток с минимальным повреждающим воздействием.
 Рис. 8 – микроманипуляции с живым оплодотворённым ооцитом мыши, находящимся на стадии завершения миграции пронуклеусов: укол в пронуклеусы
 Рис. 9 Микроманипуляции c дробящимися эмбрионами: укол в область контакта бластомеров. Используя полупроводниковую микротрубку диаметром 1,5 мкм оператору удаётся эффективно проколоть один из бластомеров в области контакта с соседом (3d-4d). Через 5 мин после окончания манипуляции бластомеры сохраняют целостность и нормальную морфологию (кадр 5d). На рисунке 9 показана последовательность микроманипуляций с ооцитом мыши с помощью Si/SiGe микротрубки диаметром 3 мкм, которая выступает за край на 80 мкм, в качестве рабочего инструмента. Удаётся эффективно прокалывать z. pellucida и оолемму (кадр 2), оператор вводит иглу попеременно в оба пронуклеуса (кадры 3, 4). Затем инструмент извлекается без повреждения мембран пронуклеусов (кадр 5,6). Следующие кадры иллюстрируют сохранение жизнеспособности и нормальной морфологии ооцита спустя 1 мин (кадр 7) и 5 мин (кадр 8) после прокола. Точкой отмечен заметный след от иглы на z. pellucida. Разработанный тип инструментов будет полезен при решении экспериментальных и практических задач, связанных, например, с точечной доставкой метки в ооциты и развивающиеся эмбрионы млекопитающих. Инструменты, созданные с применением нанотрубок, потенциально могут быть использованы во многих современных репродуктивных биотехнологиях, предполагающих микроманипуляции с эмбрионами, например, при получении трансгенных животных. трансфекция клеток в монослойной культуре плазмидой pClneoGFP путем точечных проколов мембран клеток с помощью изготовленных инструментов с микротрубками Si/SiGe закрепленными на кантилевере атомно-силового микроскопа. Поскольку прокалывание мембран клеток проводилось последовательно и фактически по одной клетке, то эффективность метода низка и демонстрирует только принципиальную применимость. Подложки с клетками помещали в «жидкостную ячейку» атомного силового микроскопа и в культуральную среду добавляли раствор плазмиды pCl-neo-GFP до концентрации 0,5 мкг/мл. Осуществляли сканирование клеточного монослоя атомным силовым микроскопом со специально изготовленным кантилевером на котором в качестве зонда-иглы закреплена полупроводниковая микротрубка. Использовали изготовленные чипы с кантилеверами с трубками-иглами диаметром 1,5 мкм. Прокол отдельных клеток осуществляли с помощью увеличения давления зонда на клетку в режиме «спектроскопии». После прокалывания мембран клеток с помощью атомного силового микроскопа, заменяли трансфекционную среду культуральной и подложки с клетками, переносили в культуральные чашки и оставляли при 37?C и 5% CO2. Эффективность трансфекции оценивали через 24 часа после микроманипуляций с клетками с помощью флуоресцентного микроскопа Axioskop 40 FL (Zeiss, Германия) при использовании комплекта фильтров №1 3 (Zeiss, Германия), с возбуждающим фильтром 470/20 нм и запирающим фильтром 505-530 нм. Флуоресценцию анализировали, используя программу для получения, обработки и анализа изображений AxioVision от Carl Zeiss. Фотографии клеток были получены путем наложения двух изображений - зеленый фильтр и изображение при сканировании на просвет (очертания клеток). Было показано наличие флуоресценции в клетках, подвергнутых проколам, что свидетельствует о наличии в данных клетках репортерного гена GFP (зеленый флуоресцирующий белок) и об успешном проведении трансфекции (Рис. 10). Данная флуоресценция не является артефактом, что подтверждается пиком свечения в конкретной клетке. Наиболее выражено флуоресценция GFP (в клетках линии подвергнутых проколам) наблюдалась через 48 часов после трансфекции (Рис.10 В). Результаты могут быть использованы при разработке больших массивов вертикальных микро-нанотрубок, способных осуществлять прокалывание и трансфекцию тысяч клеток одновременно и без применения дополнительного оборудования (микроманипулятора и атомного-силового микроскопа).
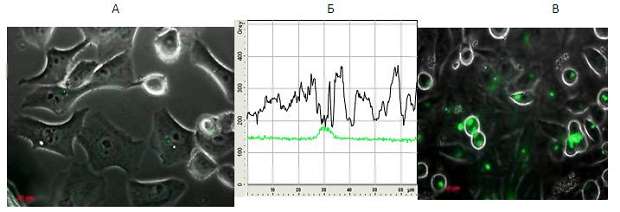 Рис. 10. Клетки линии HEp-2 через 24 часа после трансфекции. А - фрагмент препарата клеточной культуры. Б – анализ флуоресценции, В - клетки линии HEp-2 через 48 часов после трансфекции.
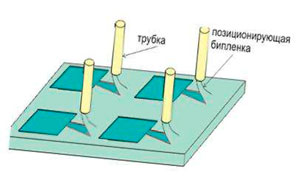
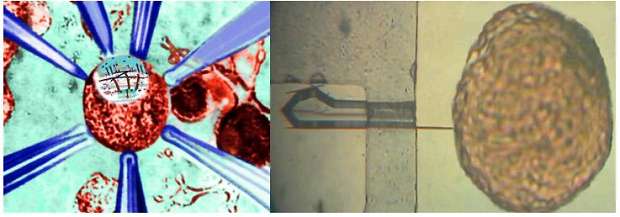 Рис. 11 Изолированный нейрон с модельными входами и наноэлектрод введенный в нервную клетку. На этапе тестирования системы планируется привлечь в качестве соисполнителей Институт химической биологии и фундаментальной медицины Сибирского отделения РАН (ИХБФМ СО РАН), ООО ПО «Сиббиофарм (ранее Бердский завод биологических препаратов), НПО Вектор, с которыми имеется опыт совместной работы. 2.5. Список основных публикаций коллектива, наиболее близко относящихся к предлагаемому проекту (каждая с новой строки) Ratushnyak A.S., Zapara T.A. Principles of Celluar-molecular Mechanisms in Neuron Functions. // J. Integrative Neurosci. Vol. 8, No. 4 (2009) 453–469. Запара Т.А., Проскура А.Л., Ратушняк А.С., Штарк М.Б., Эпштейн О.И. В стрессовых ситуациях вещества в подпороговых концентрациях могут приобретать значение условных стимулов, инициирующих защитные реакции // Бюлл. эксп. биол. мед. 2009. Т. 147(1). С. 42-44. Ol'shevskaia J.S, Kozlov A.S, Petrov A.K, Zapara T.A, Ratushniak A.S. Influence of terahertz (submillimeter) laser radiation on neurons in vitro. // Zh Vyssh. Nerv. Deiat. Im I. P. Pavlova. 2009, № 59(3). P. 353-359. Tolstikova TG, Bryzgalov AO, Sorokina IV, et al Increase in pharmacological activity of drugs in their clathrates with plant glycosides. // Letters in Drug Design & Discovery Volume: 4 Issue: 3 Pages: 168-170 Published: APR 2007. Zapara TA, Simonova OG, Zharkikh AA, Balestrino M, Ratushniak AS., Seasonal differences and protection by creatine or arginine pretreatment in ischemia of mammalian and molluscan neurons in vitro. // Brain Res. 2004 Jul 23;1015(1-2):41-9. Epstein OI, Zapara TA, Simonova OG, et al Plasticity of neuronal responses induced by low concentrations of exogenous ligands affecting cellular calcium stores. // Frontiers in bioscience Volume: 9, Pages: 809-815 Published: JAN 2004. Ratushniak AS, Zapara TA. The effect on the restructuring of the neuronal reaction of microfilament stabilization. // Dokl Akad Nauk SSSR. 1991;318(2):492-5. Shtark MB, Ratushniak AS, Voskresenskaia LV, Olenev SN. A multi-electrode perfusion chamber for tissue culture research. // Biull Eksp Biol Med. 1974 Sep;78(9):122-4. Ratushniak AS, Voskresenskaia LV, Pankova TM, Shtark MB. "Adaptive" trace reactions of hippocampal neurons in tissue culture. // Dokl Akad Nauk SSSR. 1976;228(6):1479-81. Voskresenskaia LV, Karasev NP, Pankova TM, Ratushniak AS, Stratievski? VI. A comparative statistical study of the background impulse activity of hippocampal neurons in situ and in tissue culture. // Neirofiziologiia. 1975; 7(4): 356-64. Russia. Shtark MB, Voskresenskaia LV, Ratushniak AS, Olenev SN, Popov IV. Impulse activity of hippocampal neurons in vitro. // Dokl Akad Nauk SSSR. 1972 Jan 21;202(3):734-6. V. Y. Prinz, V. A. Seleznev, A.V. Prinz and A. V. Kopylov Topical Review. 3D heterostructures and systems for novel MEMS/NEMS // Sci. Technol. Adv. Mater, 2009, v.10, p. 034502. А.В. Принц, Е.А. Кизилова, Л.В. Гришина, В.Я. Принц, Разработка методов микрохирургии клеток // Научные результаты института за 2009 год, Институт физики полупроводников СО РАН D. Gr?tzmacher, L. Zhang, L. Dong, D. Bell, B. Nelson, A. Prinz and E. Ruh, Ultra flexible SiGe/Si/Cr nanosprings // Microelectronics Journal, 2008, V. 39, Issues 3-4, Pages 478-481. A.V. Prinz, V.Ya. Prinz, Application of semiconductor micro- and nanotubes in biology. // Surface Science 2003, 532-535, pp. 911-915. A.V. Prinz, V.Ya., Prinz V.A. Seleznev, Semiconductor micro- and nanoneedles for microinjections and ink-jet printing // Microelectronic Engineering 2003, 67-68, pp. 782-788. Принц А.В., Селезнев В.А., Принц В.Я., “Микроигла в интегральном исполнении и способ ее изготовления” // Патент № 2179458, Бюллетень изобретений N5 от 20.02.2002. (вошел в 100 лучших патентов России) Настаушев Ю.В., Принц В.Я. Способ создания нанотрубок. Патент Российской Федерации RU 2238239 - Опубл. в Б.И., 2004, № 29. Принц В.Я., Голод С.В, Принц А.В, Полая игла в интегральном исполнении и способ ее изготовления, Патент №2341299, 2008.12.20 Бюл.35. (вошел в 100 лучших патентов России) Принц В.Я., Принц А.В., Копылов А.В., Электростатический микро-нанодвигатель, Патент №2374746, Бюллетень изобретений №33 от 27.11.2009. А.В. Принц, В.Я.Принц Способ изготовления острия лезвия или иглы Заявка на изобретение № 2009138998 от 21.10.2009 ИФП СО РАН, Российская федерация. Принц В.Я., Принц А.В., Способ изготовления нановолокон, Патент № 2270164, опубл. 20.02.2006 в БИ №5. Соотс Р.А., Принц В.Я.. Селективный травитель слоев AlAs, AlGaAs относительно GaAs Патент на изобретение № 2276427 опубл. 10.05.06 в БИ № 13. Принц А.В., Принц В.Я., Способ изготовления квантовых структур: квантовых точек, проволок, элементов квантовых приборов, патент № 2278815, опубл. 27.06.2006 в БИ № 18. Наумова Е.В., Принц В.Я., Структура с киральными электромагнитными свойствами и способ ее изготовления, Патент на изобретение № 2317942 опубл. 27.02.08 в БИ № 6. 2.6 Описание решаемых проблем, поставленной задачи и предлагаемых подходов к её решению: Взаимодействие между клетками образующими ткани и органы происходит с помощью сложных органических веществ и неорганических ионов и катионов, трансмембранное перемещение которых технически регистрируется как электрические импульсы. С генерацией электрических импульсов сопряжена активность сердечной, мышечной и нервной ткани. Сейчас существуют технические возможности регистрации (как правило, не продолжительной) электрических импульсов, управляющих собственной жизнедеятельностью тканей и органов, а также активностью своих тканей-мишеней (мозг - мышцы). Проблемы возникают при решении обратной задачи, ввода (подачи) записи электрических импульсов в (на) клетки тканей. В практических целях, как правило, необходима подача управляющих жизнедеятельностью электрических импульсов продолжительное время. При этом одной из важнейших проблем является небольшая долговечность электродных устройств и низкое пространственное разрешение. Для полноценного подключения к нерву необходимо иметь на площади этого контакта (несколько квадратных микрон) количество электродов хотя бы не уступающее количеству нервных отростков в этом кабеле связи (порядка тысяч отростков нервных клеток). Применение нанотрубок в качестве разъемов технических устройств открывает перспективу решения этой проблемы и протезирования на клеточном уровне. Принципиально возможно создание инертных для каждого типа клеток нанотрубок, создающих канал ввода с технического устройства записи кардио-, энцефалограмм, электрических импульсов водителей ритма дыхательного центра, сфинктров, миограмм определенных групп мышц. Толщина липидного слоя (изолятора) мембраны клетки порядка 4-5 нм. Известно, что восстановление непрерывности липидного слоя происходит, если размер повреждение не превышает толщины липидной мембраны, поэтому можно предположить что инструменты соизмеримых размеров будут проникать через мембрану (создавая контакт) без существенных ее повреждений. Конкретная фундаментальная задача в рамках проблемы, на решение которой направлен проект Проект направлен на разработку нейротехнического интерфейса, теоретико-экспериментальный анализ информационных процессов реализуемых нервными клетками и молекулярных механизмов лежащих в их основе необходимых для полноценного считывания информации из нейронных систем. Предлагаемые методы и подходы (с оценкой степени новизны; общий план работ на весь срок выполнения проекта) Основной подход, который будет применен в этом проекте, заключается в создании наноконтактов (соизмеримых с размерами контактов в нервной системе) между биологическими, нейронными и техническими информационными устройствами. Т.е практически впервые в мировой практике создания технических аналогов существующих в нейронных системах высокопроницаемых межклеточных контактов. Такие контакты (наноразмерные шлюзы) могут быть использованы для реализации клеточной терапии, для контролируемого экспериментатором введения генетических конструкций и биологически активных веществ. 3. Планируемые научно-технические результаты 3.1 Описание планируемых результатов в конце реализации (развернутое описание с оценкой степени оригинальности; форма изложения должна дать возможность провести экспертизу результатов) Решаемые задачи. В результате проекта будет создан пилотный образец биотехнического комплекса нового поколения предназначенного для считывания и ввода информации в нейроны и простые нейронные системы. Разрабатываемые устройства позволят создавать функциональные контакты как с отдельными нейронами и их отростками, так и с множеством нервных клеток в нейронных сетях. При этом создаваемое матричное устройство будет позволять, как устанавливать контакт со сформированными нейронными окончаниями, так и формировать новые контакты в процессе регенерации нейронной сети in vitro. В отличие от большинства существующих матричных устройств, в которых в качестве контактных площадок используются различные металлические поверхности (проводники электронов) в разрабатываемом комплексе предполагается создавать ион-ионные контакты с клетками. При этом переход ионный проводник-электронный проводник будет удален от биообъекта. В отличие от гелиевых контактов трубчатые ионные электроды позволяют свободный транспорт клеточных метаболитов из зоны контакта. Все это в целом позволяет выполнить соединения со стабильными в течение длительного времени свойствами. Кроме того подобные конструкции позволяют проводить мониторинг биофизических характеристик приконтактных участков клетки и управляемые воздействия на внутриклеточные молекулярные сигнальные процессы. Разработка ориентирована на создание нового поколения приборов и инструментов с качественно новыми возможностями на основе нанотехнологий для использования в бионейроинформатике и смежных областях - молекулярной биологии, цитологии, медицине. В рамках проекта будут разрабатываться, и проходить тестирование на биообъектах: матричные устройства для регистрации биофизических параметров и введения биологически активных соединений на клеточном уровне. На основе этой разработки будут создаваться биотехнические комплексы, новые методы исследования внутриклеточных сигнальных процессов и биологических информационных систем. Кроме того такие комплексы могут использоваться для анализа и отбора по биофизическим характеристикам клеток фармакологически перспективных биологически активных соединений. Один из вариантов биотехнического комплекса (рисунок 12) включает в себя набор культуральных ячеек для выращивания клеток, причем дно ячейки содержит отверстия, которые служат для удерживания нейронов и нанотрубки, выступающие из этих отверстий и перфорирующих клетки. Это позволяет создать контакт с клетками и проводить измерения, трансмембранных токов через ионные каналы клеток (по аналогии с пэтч-кламп измерениями) и оказывать необходимые воздействия на нейроны и возникающие в процессе культивирования нейронные ансамбли. Новым является то, что в цитоплазму большинства клеток через липидную мембрану входит нанотрубки, таким образом, становится возможным регистрировать мембранный потенциал и вводить биологически активные соединения непосредственно внутрь клеток, что обеспечит более простую интерпретацию регистрируемых параметров. При использовании такого комплекса становится возможным оказывать в точке контакта не только электрические стимулы, но и воздействия биологически активными соединениями. Вводить вещества ингибирующие определенные пути метаболизма или гены (ДНК, интерференционная РНК (RNAi)) ,что важно для создания полноценного долгоживущего нейрокомпьютерного интерфейса.
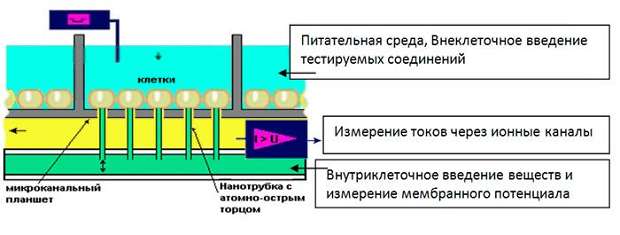 Рис. 12. Схематичная иллюстрация варианта рабочей ячейки комплекса для считывания и ввода информации в нейроны и простые нейронные системы. Комплекс должен содержать измерительную аппаратуру для разных видов электрофизиологических измерений, оптических и других биофизических, биохимических характеристик клеток. Целевые индикаторы мероприятия.
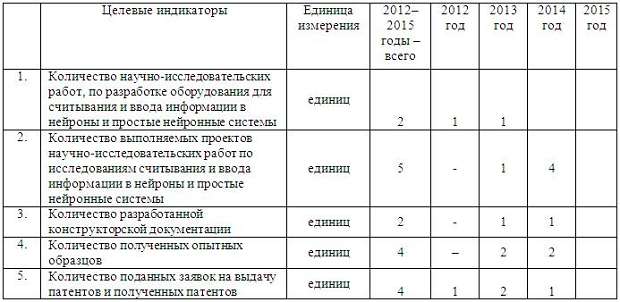 Индикаторами выполнения указанного мероприятия являются: количество выполняемых проектов научно-исследовательских работ по разработке оборудования для считывания и ввода информации в нейроны и простые нейронные системы, количество поданных заявок на выдачу патентов и полученных патентов. Использование биотехнического аппаратно-программного комплекса позволит существенно ускорить разработки промышленных образцов долгодействующих устройств прямого взаимодействия нервной ткани с искусственными системами. Позволит удешевить анализ клеточно-молекулярных механизмов действия биологически активных соединений и воздействий. Расширение спектра, регистрируемых характеристик клеток при первичном скрининге, позволит быстрее и эффективнее находить новые перспективные соединения из ранее синтезированных и отклоненных при прежних методологиях тестирования. Это позволит существенно снизить необходимые затраты на следующих этапах разработки. 3.2 Предпосылки для успешного завершения работ (реальность получения ожидаемого научно-технического результата) Главной предпосылкой для успешного выполнения работ является наличие коллектива высококвалифицированных специалистов в данной области, имеющего значительный задел и комплекса технологий и оборудования, необходимых для выполнения работ. 3.3 Оценка рисков выполнения проекта Основным риском данного проекта является возможность более быстрых продвижений в данном направлении возможных зарубежных конкурентов обусловленных значительными финансовыми и инфраструктурными возможностями. 3.4. Перечень оборудования и материалов, имеющихся у коллектива для выполнения проекта Аппаратно программные комплексы для проведения электрофизиологических исследований. Микро-нано инструменты Института физики полупроводников СО РАН. Конфокальный микроскоп и линейка микроскопов центра коллективного пользования ИЦиГ для проведения исследований с использованием флуоресцентных меток. Животные из SPF-вивария ИЦиГ СО РАН и ЦКП «Центр генетических ресурсов лабораторных животных». Вспомогательное оборудование, обеспечивающее подготовку и культивирование изолированных нейронов и срезов гиппокампа, изготовление микроинструментов и т.д. 3.6.Перечень оборудования и материалов, которые необходимо дополнительно приобрести, изготовить или отремонтировать для успешного выполнения проекта; обосновать необходимость его приобретения. Нейробиофизический комплекс на основе двухфотонного лазерного микроскопа. Микроматрицы, нано инструменты - производство на технологической линии ИФП СО РАН. Расходные материалы: Культуральные среды, флуоресцентные маркеры, вещества, селективно регулирующие активность внутриклеточных сигнальных путей и структурных элементов и контролирующих их протеинкиназ. 4. Примерный календарный план и ориентировочный бюджет расходов Таблица 1.
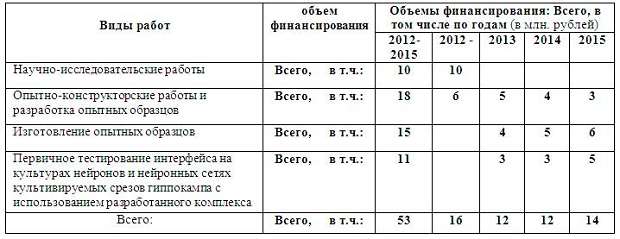 (Виды работ с указанием человеко-месяцев и предполагаемой стоимости работ. Предполагаемый календарный план с учетом взаимозависимости этапов работы).
 Координаторы работ по теме: Зав. лабораторией биомедицинской информатики КТИ ВТ СО РАН, д.б.н. А.С. Ратушняк Зав. лабораторией трехмерных наноструктур ИФПП СО РАН, д.ф.-м.н. В.Я. Принц
|